Lektion 1, Thema 1
In Bearbeitung
Zusammenfassung
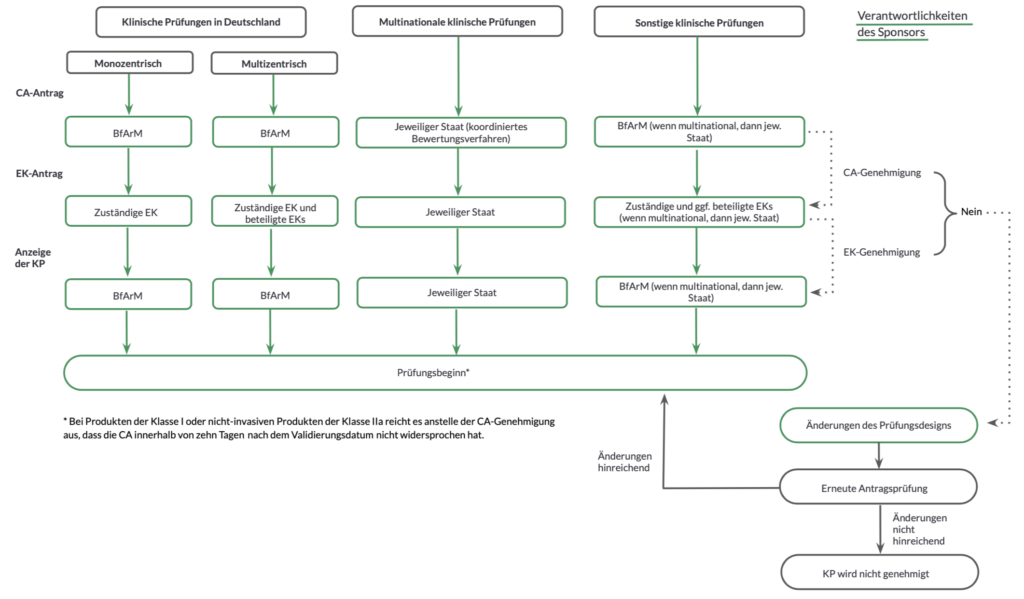
Je nach Art der klinischen Prüfung gibt es unterschiedliche Vorgaben zum Genehmigungsverfahren. Mit Blick auf diese Vorgaben können klinische Prüfungen von Medizinprodukten wie folgt unterschieden werden:
- klinische Prüfungen in Deutschland
- monozentrisch
- multizentrisch
- klinische Prüfungen in mehreren Ländern des EWRs (multinational)
- sonstige klinische Prüfungen, die ein bereits CE-zertifiziertes Medizinprodukt innerhalb dessen Zweckbestimmung prüfen
Die Komplexität der Vorschriften macht es schwierig, diese in einer einzelnen Grafik zusammenzufassen. Im Folgenden wird versucht, die zentralen Bestimmungen aus MDR und MPDG – vom Antrag bei der zuständigen Behörde (CA) bis zum Start der klinischen Prüfung – möglichst übersichtlich darzustellen: